Маркировка лекарственных препаратов в аптеках. О чём нужно знать в 2023 году?
Впервые специалисты фармацевтической отрасли столкнулись с понятием «маркировка» в 2015 году. В конце декабря 2017 года был принят закон 425-ФЗ, который внёс важные для реализации лекарств правки в закон № 61-ФЗ «Об обращении лекарственных средств», обязав производителей маркировать лекарства средствами идентификации, а участников оборота отчитываться обо всех проводимых с ними операциях в систему Мониторинга движения лекарственных препаратов (МДЛП).
А как обстоит ситуация сегодня? В статье мы расскажем про действующие правила маркировки, последние новости и требования к маркировке лекарственных средств и других товаров аптечного ассортимента. Помимо этого мы рассмотрели особенности участников системы мониторинга и ответили на популярные вопросы.
Содержание
Документы
Маркировка — это нанесение производителем или импортером на продукт, вторичную или транспортную упаковку специальной марки, которая является идентификатором, подтверждающим подлинность товара.
Функции маркировки на фармацевтическом рынке
Основные функции маркировки заключаются в защите рынка от попадания некачественных лекарственных препаратов или товаров аптечного ассортимента и в предоставлении возможности каждому участнику оборота проверить подлинность товара, его производителя и срок изготовления.
В ст. 4 Федерального закона от 12.04.2010 № 61 «Об обращении лекарственных средств» определено три группы некачественных лекарственных препаратов:
- недоброкачественные — лекарство, которое не соответствует требованиям фармакопейной статьи, нормативной документации или нормативного документа;
- контрафактные — лекарство, которое находится в обороте с нарушением гражданского законодательства;
- фальсифицированные — лекарство, которое сопровождается ложной информацией о производителе или составе.
Последние две группы препаратов редко проходят надлежащий контроль в ходе их производства и изготовления, из-за чего могут быть опасными для людей. Для защиты препаратов от подделок производители используют различные предупредительные меры: изменение упаковки, защитные голограммы, специальные идентификационные знаки или специфические шрифты и так далее. Однако даже они не гарантируют полной защиты.
Статья 46. Маркировка лекарственных средств
12. На вторичную (потребительскую) упаковку лекарственного препарата наносится штриховой код.
Федеральный закон № 61-ФЗ «Об обращении лекарственных средств»
Именно с целью повышения безопасности лекарственных препаратов, на фармацевтическом рынке России была внедрена система маркировки при помощи специальных кодов.
Штрих-код — это графическая информация (последовательность полос или других геометрических фигур), которая наносится на упаковку товаров для считывания ее техническими средствами. Чаще всего используется EAN-код — линейный. Он может кодировать небольшой объем информации.
Если в самом начале она действовала в отношении лекарственных препаратов, то постепенно вводится повсеместная маркировка в отношении продуктов детского питания, БАДов, антисептиков, воды и других товаров, которые реализуют аптеки.
Например Постановление Правительства РФ № 673 «О проведении на территории Российской Федерации эксперимента по маркировке средствами идентификации биологически активных добавок к пище» регламентирует эксперимент по маркировке средствами идентификации БАД, проводимый с 1 мая 2021 года по 28 февраля 2023 года.
Аналогичные задачи в отношении кожных антисептиков поставлены в Постановлении Правительства РФ № 1240 «О проведении на территории Российской Федерации эксперимента по маркировке средствами идентификации парфюмерно-косметической продукции, предназначенной для гигиены рук, с заявленным в маркировке потребительской тары антимикробным действием, а также кожных антисептиков — дезинфицирующих средств».

В планах Минпромторга стоит запуск обязательной маркировки БАД и антисептиков сразу после завершения эксперимента. Предусмотрен переходный период для производителей и импортеров, который будет длиться до 1 апреля 2023 года. Розничные поставщики должны будут настроить системы передачи информации о кодах проданных БАД и дезсредств до 1 сентября 2023 года.
Как работает система маркировки
Идентификатор к товару привязывают производители или импортеры, после чего он поступает к оптовикам и в розничные точки. Каждый участников оборота должен зафиксировать операции, которые совершаются над маркированным товаром.
Как правило, фиксируется две основные операции: приёмка и отпуск потребителю. В случае аптеки к таким операциям относятся приёмка товара от оптового поставщика и отпуск физическому лицу. Каждый участник оборота для регистрации операций использует специальные квалифицированные электронные подписи (КЭП).
Таким образом формируется логистическая цепочка, которая позволяет проследить путь промаркированного товара от производителя к конечному потребителю. Несанкционированному участнику, например изготовителю фальсифицированных лекарственных средств, очень сложно «вклиниться» в эту цепочку, так как незаметно получить и использовать КЭП законного участника оборота практически невозможно.
Прочитать QR-код на упаковке и отследить логистическую цепочку может каждый участник, включая конечного покупателя.
Глава Росздравнадзора в июне 2022 года отмечала, что за последние пять лет общее количество забракованных серий лекарств (фальсифицированных, контрафактных и недоброкачественных) уменьшилось в четыре раза. В том числе благодаря введению системы маркировки.

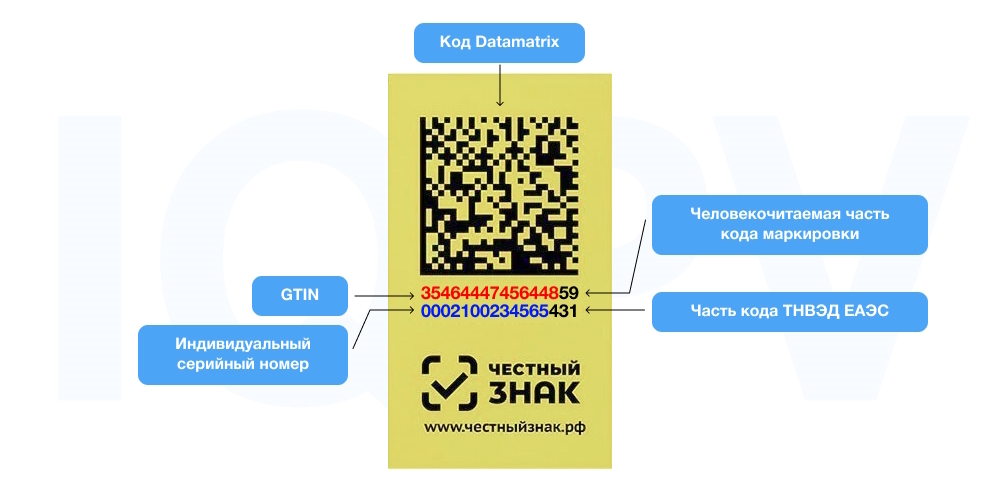
Код маркировки. Что это и как выглядит
В ходе маркировки на упаковку товара наносят уникальный двухмерный Data Matrix код. Код этого формата содержит защищенную криптографическим образом информацию и полностью соответствует международным стандартам и критериям защищенности.
DataMatrix — это двумерный матричный штрих-код в виде чёрно-белых элементов или элементов различных степеней яркости, обычно представленный в форме квадрата. Матричный штрих-код применяется для кодирования текста и данных других типов.
Код наносит производитель товара на вторичной упаковке, а при её отсутствии — на первичной.
Внешне Data Matrix код поход на двухмерный матричный идентификатор, состоящий из четырех частей. Нанесённый на упаковку лекарства код должен иметь размерность 36 на 36 модулей. Он включает:
- GTIN (Global Trade Item Number — международный код маркировки товарной позиции, который присваивается по стандарту GS1) — 14 символов;
- индивидуальный серийный номер препарата — 13 символов;
- ключ поставки — 4 цифры;
- проверочный код из цифр или сочетания цифр и букв — 44 символа.
Общая длина идентификационного знака составляет 83 символа. Рекомендованный размер кода Data Matrix ― 16×16 мм, однако допустимы и меньшие размеры.
На большую транспортную тару, такую как паллеты или коробки, наносятся коды формата GS1 128, в которых содержится информация обо всех упаковках.
Коды Data Matrix применяются при операциях по приёмке, передаче, перемещении и выводу лекарственных средств из оборота. Чтобы узнать статус товара, нужно отсканировать код при помощи сканера или мобильного приложения системного мониторинга «Честный знак». Считывание кода производится на каждом этапе движения товара.

Кто участвует в системе маркировки
В обороте маркированных фармацевтических товаров участвуют:
- производители;
- оптовые компании;
- розничные точки — аптеки;
- медицинские организации.
Каждая категория имеет свои особенности учёта.
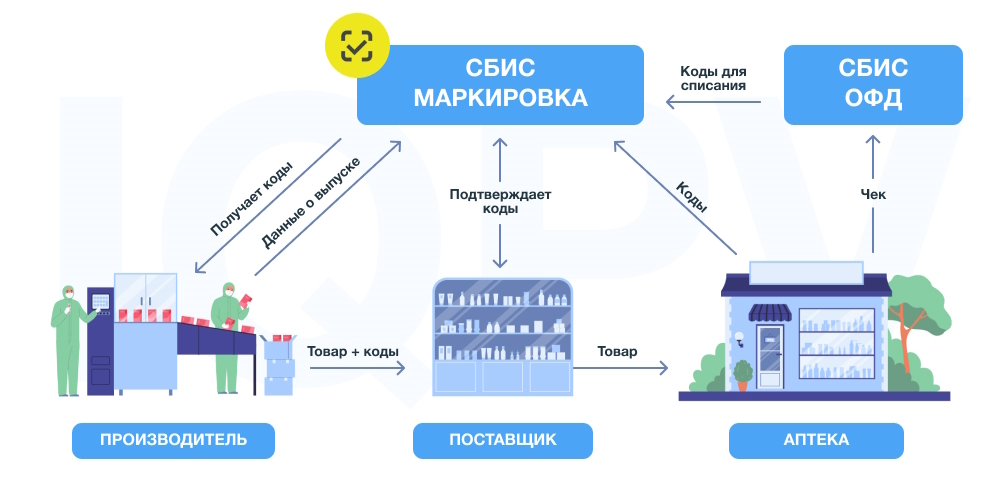
Особенности работы с системой маркировки
Можно выделить общую схему взаимодействия между участниками оборота:
- Производитель получает коды в системе маркировки и размещает их на упаковках лекарственных препаратов.
- Во время отгрузки вместе с товаром производитель передаёт дистрибьютору список кодов.
- Дистрибьютор проводит приёмку товара и подтверждает получение кодов.
- Дистрибьютор выполняет расфасовку товара и направляет его в аптеку.
- Аптека проводит приёмку, во время которой происходит сканирование кодов с упаковок лекарств.
- Отсканированные коды направляются поставщику в систему МДЛП (Мониторинг Движения Лекарственных Препаратов).
- При отпуске и продаже фармацевт или провизор сканирует код маркировки на упаковке, после чего оператор фискальных данных отправляет его в систему маркировки.
- Код выбывает из оборота.
Таким образом отслеживается весь путь перемещения лекарственных препаратов, начиная с момента производства и до их получения покупателями. Контролирующие органы в любой момент времени смогут узнать, где находится фармацевтический товар и сколько времени осталось до окончания срока его годности.
Отгрузка лекарственных средств может проходить по прямому или обратному акцепту:
- прямой порядок акцептования («прямой акцепт»). Сведения об отгрузке товара регистрируются отправителем. Получатель подтверждает зарегистрированные в системе сведения;
- обратный порядок акцептования («обратный акцепт»). Сведения об отгрузке товара регистрируются получателем. Отправитель подтверждает зарегистрированные в системе сведения.
«Прямой акцепт» более точен, так как проверка штрих-кодов производится как со стороны получателя, так и со стороны отправителя. Это уменьшает вероятность возникновения пересортицы. Но не все дистрибьюторы готовы к такой форме работы — для этого требуется дополнительные оборудование и персонал.
Поэтому «Обратный акцепт» остается самым распространенным способом взаимодействия дистрибьютора с аптечными сетями. Аптека, получив поставку, должна просканировать все упаковки товара в рамках одной накладной, сформировать документ установленного вида и отправить его в систему мониторинга движения лекарственных средств. Эта информация сверяется с данными, которые вносит дистрибьютор. Если данные совпадают — считается, что поставка состоялась. Аптека получает сообщение, что поставка принята.

Программа маркировки лекарственных препаратов даёт возможность быстро принять партию лекарственных средств и других товаров аптечного ассортимента любого объема. Специализированное программное обеспечение позволяет провести приём и отказ от приема, возврат и выбытие товаров, а также узнать статус маркировочного кода препарата.
Розничная продажа лекарств в аптеках
Система мониторинга маркированных товаров имеет несколько видов вывода лекарственных препаратов из оборота:
- розничная продажа — аптека отпустила товар покупателю за полную стоимость;
- льготный отпуск — аптека отпустила товар покупателю за частичную стоимость;
- вывод из оборота для оказания медицинской помощи — вывод лекарства из-за использования медицинской организацией для предоставления медицинской помощи;
- вывод из оборота по иным причинам.
К иным причинам относится уничтожение препарата и списание без передачи на уничтожение, недостача, производственный брак, частичное списание и так далее.
Для «вывода» лекарства из оборота аптеке требуется контрольно-кассовая техника, актуальное кассовое программное обеспечение и сканер для считывания 2D-кодов.
Особых различий в реализации аптекой лекарственных препаратов и других товаров нет. Фармацевт или провизор при отпуске товара сканирует код маркировки, который вместе с другой информацией автоматически поступает в систему мониторинга. Передача сведений происходит в несколько этапов:
- при расчёте с покупателем формируются фискальный документ и кассовый чек;
- фискальный документ шифруется и передается ОФД (Оператору фискальных данных), а затем поступает в ФНС (Федеральную налоговую службу);
- ФНС подтверждает операцию и передаёт сведения в систему мониторинга.

Чтобы избежать ошибок при реализации товара, рекомендуется придерживаться следующего алгоритма действий при отпуске маркированных товаров:
- Получение запроса от покупателя и предоставление фармацевтической консультации.
- Подобрать подходящие покупателю лекарственные препараты и получить его согласие на их покупку.
- Последовательно считать при помощи сканера коды маркировки DataMatrix с каждой упаковки лекарственных препаратов. При повторном сканировании одной и той же упаковки регистратор выбытия не добавит ее в список для вывода из оборота, а сообщит об ошибочном сканировании.
- Проверить корректность считывания кодов маркировки.
- Получить оплату за товары аптечного ассортимента и пробить кассовый чек.
- Передать покупателю товар, сдачу и кассовый чек.
Похожим образом построена пошаговая инструкция отпуска лекарственных препаратов по льготным рецептам:
- Получить от покупателя льготный рецепт.
- Подобрать подходящие препараты для отпуска и получить согласие покупателя на их отпуск.
- Последовательно считать при помощи сканера коды маркировки DataMatrix с каждой упаковки лекарственных препаратов.
- Ввести дату, серию и номер рецепта на регистраторе выбытия или в товарно-учетной системе, после чего выбрать действие «Зарегистрировать выбытие».
- Выдать товар покупателю после появления на дисплее регистратора сообщения об отправке запроса.
Вопросы и ответы
Что делать, если упаковка продается не целиком?
В момент отпуска только части упаковки, происходит «частичное» выбытие вторичной упаковки. Она должна сохраняться до момента отпуска последней доли упаковки. Для этого необходимо ввести «долю» упаковки на кассовом ПО.
В случае обнаружения попытки осуществить вывод «излишка» система мониторинга зафиксирует нарушение!
Что делать, если покупатель отказался от покупки?
Бывает, так что покупка не состоялась (отказ по инициативе покупателя, отсутствие необходимой суммы денежных средств), а маркированный лекарственный препарат «пробит» на кассе в аптеке.
В этом случае чек не закрывается и должен быть аннулирован посредством программного обеспечения.
Операция пробития чека не состоялась — информация не передалась ОФД, поэтому сведения о выбытии товара в системе мониторинга не зафиксировались.

Заключение
Введение обязательной маркировки лекарственных средств было необходимым решением для снижения доли контрафактных и поддельных лекарственных средств в обороте. Перед проектом «Маркировка» стоят масштабные цели, но их достижение обеспечит результаты, в которых заинтересованы все участники жизненного цикла препарата.
Внедрение системы мониторинга и перестройка рабочего процесса изначально могут показаться сложными и пугающими. Но стоит запастись терпением, выполнять необходимые рекомендации, и в скором времени каждый сотрудник фармацевтической отрасли сможет оценить важность этого проекта.
Источники:
Обязательная маркировка лекарственных средств — особенности
Методические рекомендации по работе с маркированными лекарственными препаратами (утв. Росздравнадзором)






Авторизуйтесь, чтобы оставить комментарий.