
В связи с востребованностью БАДов на фармацевтическом рынке становится актуальным обзор нормативных документов, которые регламентируют их оборот. А также вопрос маркировки в рамках эксперимента, который сейчас проводит Минпромторг РФ.
В статье мы подробно рассмотрели основные правовые требования к обороту БАД на российском рынке, а также затронули тему маркировки биологически активных добавок, которая сейчас проходит стадию эксперимента.
Содержание
Документы
Пандемия COVID-19 внесла коррективы в отношение людей к своему здоровью. На первый план вышли вопросы поддержания иммунитета и укрепление общего состояния организма, чтобы он мог противостоять вирусам. В связи с этим существенно увеличилась востребованность биологически активных добавок к пище, далее — БАД.
По данным DSM Group, спрос на БАДы увеличивается с каждым годом. Положительная тенденция сохраняется и в 2022 году: в январе продажи добавок составили 8,9 млрд руб., а в марте уже 13,2 млрд руб.
Правовое регулирование оборота БАД
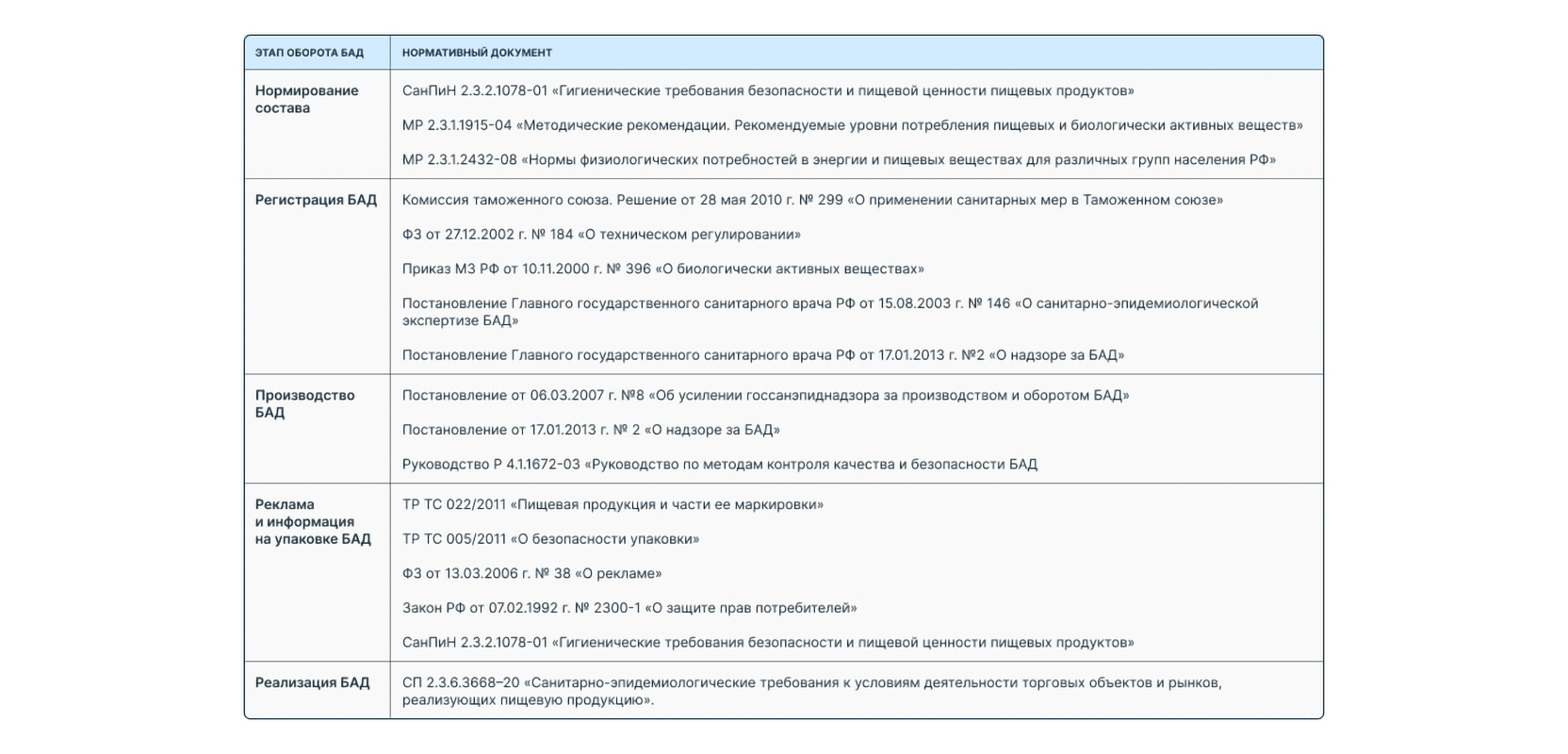
Контроль за оборотом БАД осуществляет Роспотребнадзор. Процесс регулируют 8 основных документов и 16 дополнительных. В последних описаны требования к отдельным этапам оборота.
Основные нормативные документы:
- ТР ТС 021/2011 «О безопасности пищевой продукции» — определение БАД и их место в системе пищевых товаров.
- ТР ТС 029/2012 «Требования безопасности ....» — информация о правилах обращения пищевых добавок на рынке и требования безопасности.
- ФЗ № 29 от 02.01.2000 г. «О качестве и безопасности ...» — определение БАД на территории РФ.
- ФЗ от 31.12.2014 г. № 532 «О внесении изменений в ...» — регламентация последствий производства и оборота некачественных БАДов.
- ФЗ от 30.03.1999 г. «О санитарно-эпидемиологическом благополучии населения» — определение, что БАДы, их производство, транспортировка, хранение и реализация должны соответствовать санитарным требованиям.
- Методические указания 2.3.2.721-98 «Определение безопасности ...» — порядок действий организаций на всех этапах оборота БАД, в том числе даны указания, какие добавки не допускаются к реализации.
- ГОСТ Р 56202-2014 «БАД. Требования к производству ...» — регламентация процесса изготовления добавок, требований к производственным помещениям и оборудованию, хранению и транспортировке БАД. Перечислены документы, которыми должно сопровождаться производство.
- ГОСТ Р 55793-2013 «Продукты пищевые...» — описание, как документально определить производителя и собственников в обороте биологически активных добавок.
Ранее действовал СанПиН 2.3.2.1290–03 «Гигиенические требования...», который утратил силу с 1 января 2021 года.
Дополнительные нормативные акты, регулирующие оборот БАД, перечислены в таблице.
О правилах продажи БАД, уголовной и административной ответственности в сфере их оборота можно почитать в статье «БАДы — правила продажи биологически активных добавок».
Требования к упаковке, хранению и ликвидации некачественных БАД
За производство, регистрацию и транспортировку биологически активных добавок несет ответственность производитель. Фармацевт же отвечает за их реализацию и хранение, а также за утилизацию некачественных и просроченных партий.
В ходе приемочного контроля БАДов первостольник особое внимание уделяет этикеткам продукции. По действующим требованиям на них должна быть написана информация на русском языке о биодобавках. В ней обязательно должны быть указаны:
- наименование БАД;
- ее состав;
- количество элементов в упаковке;
- дата изготовления;
- срок годности;
- условия хранения, в том числе после вскрытия, если они отличаются от общих;
- наименование или ФИО для индивидуального предпринимателя и место нахождения изготовителя;
- процентное содержание биологических добавок или общее количество жизнеспособных бактерий в капсуле, таблетке или пакетике;
- сведение о нормативной документации, на основании которой произведен продукт;
- номер и дата оформления свидетельства о государственной регистрации;
- штрих-код.
Если есть товарный знак или производитель проходил добровольную сертификацию, он также обязан указать эти сведения на упаковке.
Информация должна быть хорошо читаема и не стираться. Размер шрифта с указанием наименования, даты изготовления и срока годности БАД должен быть не менее 2 мм.

Хранить биодобавки надо в соответствии с инструкцией производителя. Если в ней написаны формулировки «прохладное, сухое место», рекомендовано опираться на требования Государственной фармакопеи.
Если биодобавки не ведут к загрязнению пищевых продуктов, их можно хранить вместе с другими лекарствами. Чтобы избежать путаницы и ошибок в реализации аптечных товаров, под БАД нужно выделить отдельную полку или контейнер с маркировкой.
Добавки нельзя хранить на полу, даже в зоне приемки. Для осмотра товара выделяют стол или ставят поддон.
Если в ходе оценки были выявлены фальсификаты, контрафакты, а также просроченные БАДы, их изымают из оборота и помещают в карантинную зону. Требования к их хранению прописаны в статье 18 ТР ТС 021/2011.
Изъятые единицы надо идентифицировать и учесть. Сотрудник, отвечающий за учет, несет ответственность за сохранность всех позиций до момента утилизации. Уничтожить добавки можно любым технически возможным способом при условии, что не будет нанесен вред людям, животным и окружающей среде.
Несколько слов о маркировке БАД
В рамках эксперимента с 1 мая 2021 года производитель может подать заявку на маркировку биологически активных добавок уникальным контрольно-идентификационным знаком. Первоначально планировалось, что эксперимент завершится к 31 августа 2022 года, однако он продлен до 28 февраля 2023 года. Поправки в Постановление от 29 апреля 2021 года № 673 ожидаются.
Маркировка позволит проследить путь добавок от производителя к месту реализации. По мнению экспертов Роспотребнадзора, фармацевтам будет проще выявить контрафактную и фальсифицированную продукцию и уничтожить ее до реализации покупателям аптек.
Участие в эксперименте добровольное. Процедура позволяет производителю наладить процесс маркировки и избежать технических трудностей в будущем, когда она станет обязательной. По данным национальной системы цифровой маркировки «Честный знак» в проекте уже приняли участие 2553 производителя биологически активных добавок.

Что должен помнить фармацевт при реализации БАД
По закону биодобавки можно выкладывать в торговом зале вместе с остальными лекарственными препаратами. Однако, чтобы не вводить покупателя в заблуждение, что перед ним БАД, а не лекарство, они должны быть отделены от медикаментов. Их можно разместить на отдельной витрине или полке с надписью «Биологически активные добавки». Эти же слова должны быть написаны на ценниках.
Если на листке-вкладыше есть сведения о влиянии БАД на состояние потребителя, и они не продублированы на упаковке, фармацевт обязан рассказать о них покупателю. Важно проконсультировать до покупки, чтобы у покупателя не было заблуждений относительно качества и свойств добавки.
Источники
- Гаммель И. В. и др. «Современные аспекты классификации и регулирования оборота биологически активных добавок к пище» // Медицинский альманах. 2017. № 1 (46);
- Гарбузова Л. «Требования к обороту БАД в 2021 году: действующие техрегламенты и санитарные правила» // Новая аптека. Апрель 2021. № 4;
- «Рынок БАДов и витаминов в условиях санкций: перспективы развития биодобавок в 2022 году» // Аналитическая онлайн-статья компании «Деловой профиль».
Проверь знания по статье

Другие статьи по теме «Продажи в аптеке»
Смотреть все
Комментарии
Количество комментариев 17

Светлана Ц. ООО Элифант
Спасибо

Юлия Б.
Эксперт комьюнити АС "Здесь Аптека"
Пожалуй, мы уже научились жить и дружить с обязательной маркировкой. Тема очень актуальная и важная. Беру на заметку для студентов. Благодарю за такой материал. Нюансы конечно возникают и по БАД, и по медизделиям, но возможно все решить.

Ольга С. Мелздрав Нижний Новгород
спасибо!

Людмила Ж. Эркафарм
Спасибо!
Ирина Д. ВИТАМЕД (КРАСНОЯРСК)
спасибо
Анастасия Д. ФК КАЛИНА (АБАКАН)
Спасибо.

Татьяна З. ООО "Эркафарм Поволжье"
Спасибо большое за информацию!
Тамара Д. ФИТОФАРМ
Спасибо.Очень интересная информация.
Елена М. С.О.Ц. Аптека
спасибо

Елена Д. ГУП Башфармация
Спасибо! Актуально.
Валентина С. Максавит
спасибо

Виталина К.
Эксперт комьюнити Аптека ИП
спасибо за информацию

Анна З. ООО здоровье
Спасибо

Антонина К. Мелодия здоровья
Спасибо, интересно

Анна Ж. Эркафарм
спасибо за информацию

Елена Ч. ГКУ НСО «Новосибоблфарм»
Отлично

Татьяна З. ООО "Эркафарм Поволжье"
Спасибо за информацию.
Сайт носит обучающий (информационный) характер и предназначен исключительно для обучения (информирования) фармацевтов и провизоров









Авторизуйтесь, чтобы оставить комментарий.